قلیاییت(Alkalinity) به عنوان یکی از شاخص های مهم ارزیابی کیفی آب برابر است با مجموع غلظت های یون های بی کربنات و کربنات و هیدروکسید. قلیائیت آب نشانگر میزان مقاومت آب در برابر تغییر PH ناشی از افزوده شدن محلول های اسید یا باز به آن است.
پیش نیاز درک شاخص کیفی قلیاییت آب، بررسی مفهوم تعادل یونی در آب است. آب دیونیزه یا آب خالص متشکل از یونهای هیدروژن و هیدروکسید تقریباً نارسانای جریان الکتریکی است و از آن جا که رسانایی الکتریکی آب به معنای حضور یون های مثبت و منفی در آب است، این بدان معناست که آب خالص به مقدار بسیار کم یونیزه می شود:
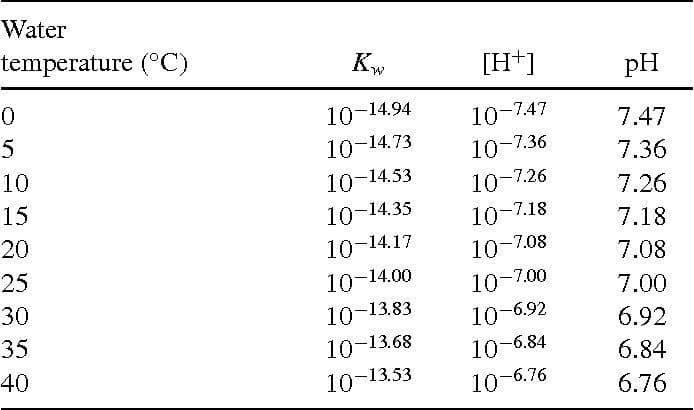
در دمای ۲۵ درجه سانتی گراد از هر ۱۰۸×۵٫۵۵ مولکول آب، تنها یک مولکول یونیزه شده و به فرم OH– و H3O+ در می آید. اگر این میزان یونیزاسیون را در قالب مدلی بازنویسی نمائیم، می توان چنین گفت که در هر لیتر آب خالص تنها ۱۰-۷ مول یون +H در تعادل با –OH منفی است:
هرچه دما بالاتر رود، میزان یونیزاسیون آب افزایش می یابد. در دمای ۶۰ درجه سانتی گراد غلظت یون +H در آب به ۶٫۵- ۱۰ افزایش می یابد. جهت سهولت در نوشتار به جای استفاده از غلظت H+ از لگاریتم این عدد استفاده می شود که به آن PH می گویند:
لذا PH و POH آب خالص در دمای ۲۵ درجه برابر با ۷ است. منحنی تغییرات ثابت یونیزاسیون آب و PH در دما های مختلف درجدول ذیل به نمایش در آمده است:
محلول بافر (Buffer Solution)
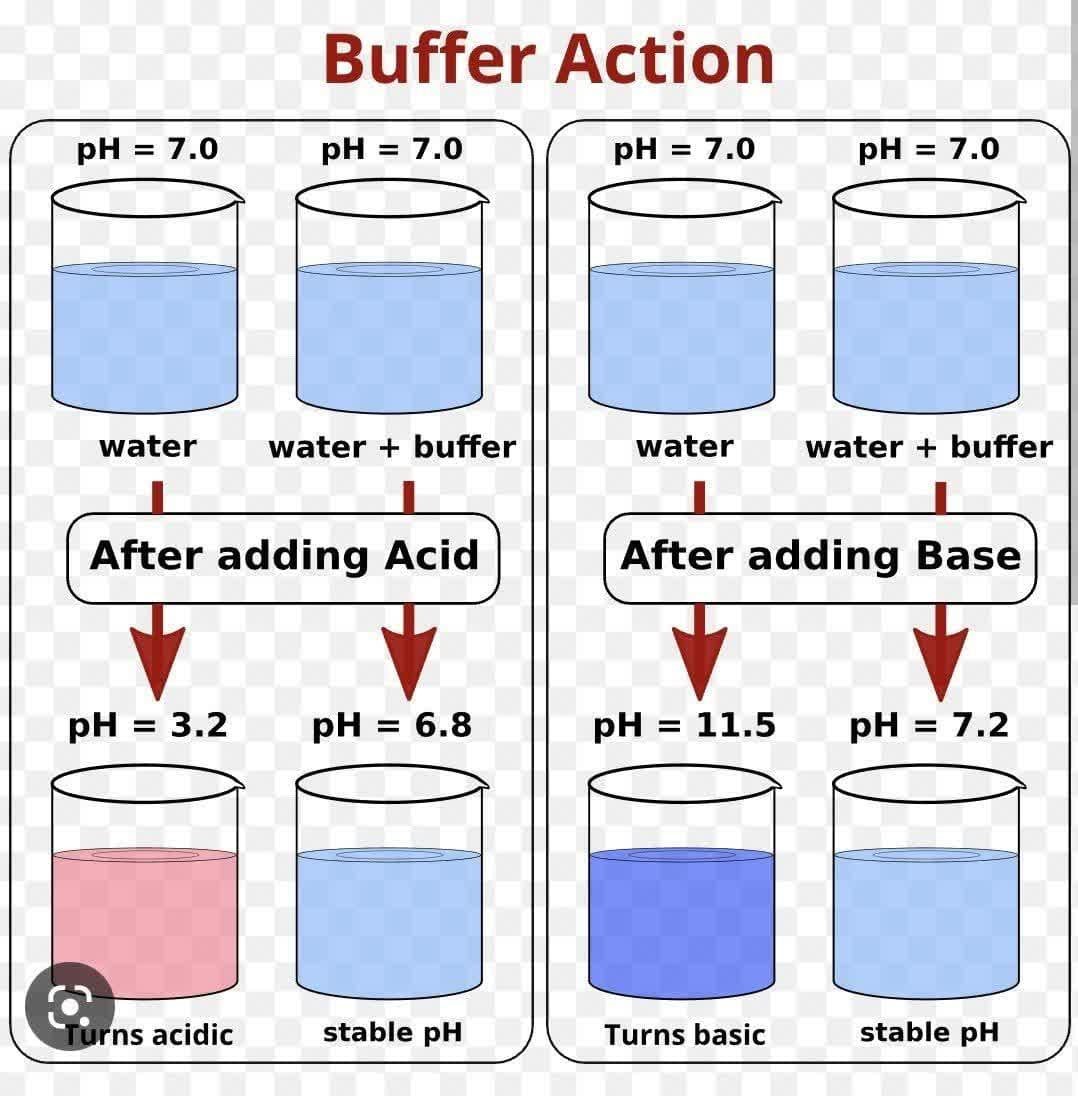
بافر محلولی است که می تواند در برابر تغییرات ناگهانی PH ناشی از افزودن اسید یا باز به آن مقاومت کند. این محلول قادر است مقدار کمی اسید یا باز اضافه شده به خود را خنثی کند و در نتیجه PH آن نسبتاً پایدار باقی بماند. از مهم ترین بافر های طبیعی موجود، خون جانداران است. تثبیت مقدار PH خون برای زنده ماندن و فعالیت بیولوژیک حیاتی است. اگر ظرفیت بافری در خون وجود نداشت، خوردن چند قطره لیمو ترش تازه می توانست منجر به مرگ شود! محلول بافر، محلولی بر پایه آب و شامل یک اسید ضعیف و نمک آن (بافر اسیدی) و یا باز ضعیف و نمک آن (بافر بازی) است.
اساس عملکرد یک بافر را می توان به فرایند تعادلی (برگشت پذیر) ناشی از یونیزاسیون اسید یا باز ضعیف نسبت داد. اسید یا باز قوی در آب به طور کامل یونیزه شده و واکنش به صورت تعادلی (برگشت پذیر) نیست. اگر اسید قوی مانند HCl را در آب وارد نمائیم، واکنش به صورت بازگشت ناپذیر و یک طرفه به شکل ذیل خواهد بود:
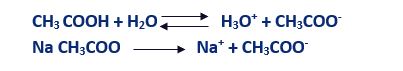
ولی اگر اسیدی ضعیف مانند اسید استیک را در آب وارد نمائیم، واکنش تعادلی (برگشت پذیر) به شکل ذیل خواهیم داشت:
اگر یک اسید ضعیف مانند همین اسید استیک را با نمک (باز مزدوج) آن مانند استات سدیم در آب نظر بگیریم، واکنشهای یونیزاسیون آن ها در آب به شکل ذیل خواهند بود:
نمک استات سدیم به طور کامل در آب محلول بوده و انحلال آن به صورت واکنش یک طرفه است. حال اگر اندکی اسید قوی مانند HCl به این مخلوط اضافه کنیم تأثیر این افزایش به شرح ذیل خواهد بود:
اضافه شدن H3O+ علی الاصول می بایست منجر به کاهش PH شود؛ ولی این افزایش H3O+ با حضور مقادیر کافی از یون استات (CH3COO–) در آب، واکنش دو طرفه یونیزاسیون اسید استیک را به سمت چپ سوق خواهد داد (اصل لوشاتلیه) و نتیجه آن، مصرف مقدار اضافی H3O+ وارد شده (ناشی از تزریق اسیدکلریدریک) و تبدیل آن به CH3COOH است؛ بنابراین این مخلوط نسبت به کاهش PH مقاومت خواهد کرد.
حال اگر به این مخلوط مقداری باز قوی مانند هیدروکسیدسدیم اضافه کنیم، تأثیر این افزایش به شرح ذیل است:
افزایش غلظت OH– علی الاصول می بایست منجر به افزایش PH شود؛ ولی این افزایش OH– با مصرف H3O+ موجود در مخلوط واکنش تعادلی یونیزاسیون ناقص اسید استیک در آب به سمت راست و تولید بیشتر H3O+ در جهت جبران مقدار مصرف شده آن سوق خواهد داد؛ بنابراین این مخلوط نسبت به افزایش PH مقاومت خواهد نمود.
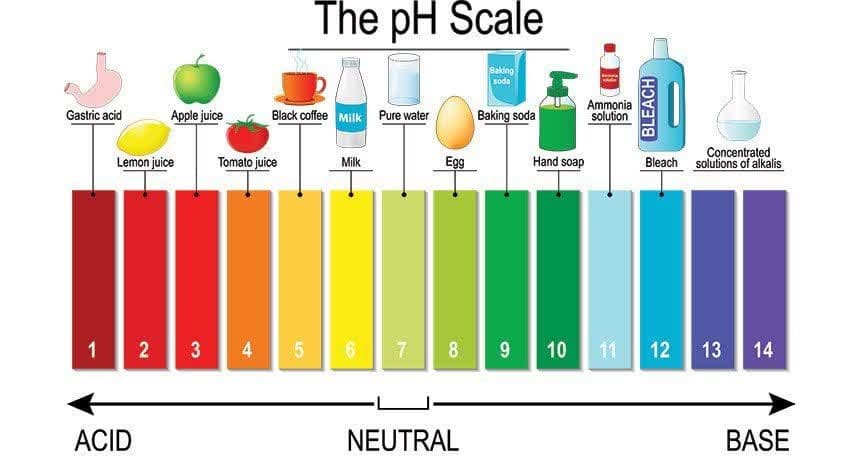
همانطور که قبلا اشاره شد، شاخص PH(Potential of Hydrogen) بیانگر میزان خاصیت اسیدی و یا بازی بودن نمونه و عددی بدون بعد در بازه صفر تا چهارده است.
این پارامتر بسیار مهم در گزارش آنالیز آب، تعیین کننده بازدهی اغلب فرایندهای مرتبط با تصفیه آب شرب و صنعتی است که در اینجا به مثال هایی از آن اشاره می کنیم:
در طراحی آب شیرین کن های دریایی برخی استانداردهای سخت گیرانه کیفیت آب شرب نظیر استاندارد WHO سال ۲۰۰۶، حضور عنصر بور (BORON ,B) در غلظت های بالاتر از ۰٫۵ میلی گرم بر لیتر در آب خروجی به عنوان عاملی در افزایش ریسک سقط جنین مطرح است.
جهت حذف بهینه این عنصر خصوصا در آب های با محتوای بالاتر از ۰٫۵ میلی گرم بر لیتر مانند ساحل خلیج فارس در استان بوشهر، یکی از کارآمد ترین فرایندها، افزایش PH در آب پیش تصفیه شده ورودی به SWRO تا محدوده ۹٫۲ است.
در حالت PH طبیعی آب دریا (حدود ۸) عنصر بور اغلب به فرم اسید بوریک H3BO3 است که به دلیل خاصیت اسیدی ضعیف، یونیزه نشده و در نتیجه، به آسانی از غشای اسمزمعکوس نفوذ و وارد بخش Permeate میشود. با افزایش PH به محدوده ۹٫۲ واکنش هیدرولیز ذیل منجر به تشکیل بورات می شود:
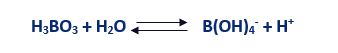
شايان ذكر است كه بالا بردن PH در ورودي آب شيرين كن صنعتي ممكن است كه اشباع شدن تركيبات ديگري نظير كربنات كلسيم را به دنبال داشته باشد كه منجر به رسوب گذاري به روي ممبران ها شود. از اينرو انتخاب PH بهينه بسيار حايز اهميت است.
بازدهی فرایند گندزدایی با کلر در PH اسیدی حدود ۶٫۵ ، به مراتب بیش از حالت قلیایی است. تا جایی که میزان بازدهی کلرزنی در PH حدود ۸ تقریبا ۲۰ درصد است ولیکن در PH خنثی به حدود ۷۰ درصد میرسد.
دی اکسید کربن عامل اسیدیته طبیعی در منابع آب
دی اکسید کربن یک مولفه معمولی در تمام آب های طبیعی است که لزوما فقط از هوای محیط وارد منابع آب نمیشود.
مطابق با قانون هنری، انحلال و جذب دی اکسید کربن در آب از طریق هوای محیط، زمانی اتفاق می افتد که فشار جزئی (پتانسیل شیمیایی) دی اکسید کربن در آب، کمتر از فشار جزئی (پتانسیل شیمیایی) دی اکسید کربن در هوای محیط باشد، ولیکن وجود این گاز در منابع آب طبیعی، منحصر به انحلال از هوا به آب نیست.
اکسیداسیون بیولوژیکی ترکیبات آلی در شرایط هوازی و بی هوازی نیز باعث تولید در اکسید کربن در آب می شود. اگر این دی اکسید کربن در سایه فرایند دیگری مانند فتوسنتز و شکوفایی جلبکی (Algal Bloom) مصرف نشود، ضمن حفظ اسیدیته آب، مازاد آن به هوای محیط دفع خواهد شد. تغییرات دما و حضور گازهای دیگر در آب نیز منجر به تغییر غلظت تعادلی گاز دی اکسید کربن در آب می شوند. چنانکه می بینیم در اثر هوادهی آب حاوی دی اکسید کربن، PH افزایش می یابد که به معنای دفع گاز از محیط آبی است و یا در بویلر ها به دلیل کاهش حلالیت گاز در دمای بالا، دفع CO2 باعث افزایش PH حتی تا محدوده ۱۱ می شود.
هر چند که تبدیل بی کربنات (سختی موقت) و رسوب گرفتگی در بویلر ها، خود بالقوه باعث آزاد شدن H+ و کاهش PH خواهد شد ولی این خروج گاز CO2 از محیط آبی در دمای بالا می تواند تاثیر بیشتری بر افزایش PH بگذارد.
از بیان موضوعات فوق چنین میتوان نتیجه گرفت که منابع آبی به طور پیوسته در حال جذب و دفع گاز دی اکسید کربن و ایجاد تعادل با محیط هستند و به دلیل غلظت پایین گاز دی اکسید کربن در هوای محیط، این غلظت تعادلی می تواند بسیار کم باشد.
در آب های زیر زمینی فعالیت های میکروبی هوازی و بی هوازی منجر به افزایش غلظت گاز CO2 حتی تا میزان ۵۰ میلی گرم بر لیتر می شود. زیرا امکان دفع آن به هوای محیط و ایجاد شرایط تعادلی فراهم نیست. بخشی از گاز CO2 حل شده در این حالت با واکنش بر خاک و سنگ منجر به انحلال و خوردگی آن ها شده و باعث تشکیل بی کربنات کلسیم یا منیزیم خواهد شد.
در PH خنثی کماکان مقادیری از گاز CO2 در آب وجود دارد که میتواند خاصیت بافری به آب بدهد و نکته دیگر اینکه، کاهش PH به مقادیر کمتر از ۴٫۵ در محیط آبی نمیتواند ناشی از حضور CO2 در آب باشد و به احتمال زیاد ناشی از حضور اسیدهای معدنی است.
آلودگی ناشی از فعالیت صنعتی نظیر آنچه در صنایع معدنی و استخراج فلزات وارد منابع آبی می شود و یا ورود شیرابه زباله به خاک و منابع زیرزمینی عاملی در تولید اسیدهای معدنی قوی و کاهش قابل توجه PH آب می شود.
محتوای سولفید موجود در این پساب ها با فعالیت باکتریایی طبیعی، طبق واکنش های ذیل تبدیل به اسیدسولفوریک و کاهش قابل توجه PH آب میشود:
قلیائیت (Alkalinity)
قلیاییت، شاخصی برای میزان ظرفیت آب برای خنثی سازی اسید افزوده شده به آن است. همانطور که در توضیح محلول های بافر به آن اشاره شد، این محلول ها در برابر تغییرات PH ناشی از افزودن اسید یا باز به آن ها مقاومت نشان می دهند. آب طبیعی نیز حالت بافری داشته و در حقیقت چنین می توان گفت که قلیائیت (Alkalinity) نشانگر میزان مقاومت نمونه آب در برابر تغییر PH ناشی از افزوده شدن اسید به آن است.
برای روشن شدن بهتر مطلب، به مثال زیر توجه کنید:
- افزودن یک یا دو قطره اسید قوی مانند اسیدکلریدریک به یک نمونه ۱ لیتری آب مقطر (که فاقد املاح و قلیائیت است) به سرعت PH را از ۷ به ۲ و یا حتی کمتر خواهد رساند. این در حالی است که اگر همین مقدار اسیدکلریدریک به یک نمونه آب چاه با املاح بالا (TDS > 500) اضافه شود PH نهایتا ممکن است از ۷ به ۵٫۵ کاهش بیابد.
- آبی که حاوی ۱ میلی گرم بر لیتر گاز دی اکسید کربن محلول و ۱۰ میلی گرم بر لیتر قلیائیت است، PH یکسان با آبی حاوی ۱۰ میلی گرم بر لیتر گاز دی اکسید کربن و ۱۰۰ میلی گرم بر لیتر قلیائیت دارد. اگر در نمونه اول مقدار مشخصی گاز دی اکسید کربن حل نمائیم، PH به سرعت و به طور محسوس کاهش یافته ولیکن اگر همین مقدار دی اکسید کربن را به نمونه دوم بیفزائیم، تغییر PH محسوس نخواهد بود.
قلیائیت (Alkalinity) آب طبیعی به دلیل بروز خاصیت بافری ناشی از حضور یون بی کربنات و اسیدکربنیک (اسید ضغیف حاصل از انحلال طبیعی گاز دی اکسید کربن موجود هوای محیط در آب) ایجاد می شود.
بنابر تعریف، قلیائیت برابر با مجموع غلظت های یون های بی کربنات و کربنات و هیدروکسید در آب است.
در تفسیر گزارش آنالیز آب و طراحی فرایند تصفیه، نه تنها پارامتر قلیائیت (مجموع غلظت آنیون های فوق) بلکه اطلاع از میزان دقیق غلظت هریک از این آنیون ها اهمیت به سزایی دارد.
تذکر: عوامل ایجاد قلیائیت در آب شامل یون های حاصل از اسید های ضعیف مانند OH–,CO32-,HCO3–,HSiO3– H2BO3–,HPO42-,H2PO4–,HS–,NH30 است. نظر به اینکه در اغلب منابع آبی حضور ترکیبات فسفری و گوگردی (به دلیل آلودگی منابع خاک ناشی از سموم و کودهای کشاورزی ) ناچیز است، مهم ترین عوامل قلیائیت در آب شامل بی کربنات (HCO3–)، کربنات (CO32-) و هیدروکسید (OH–) است.
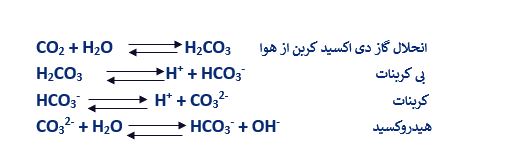
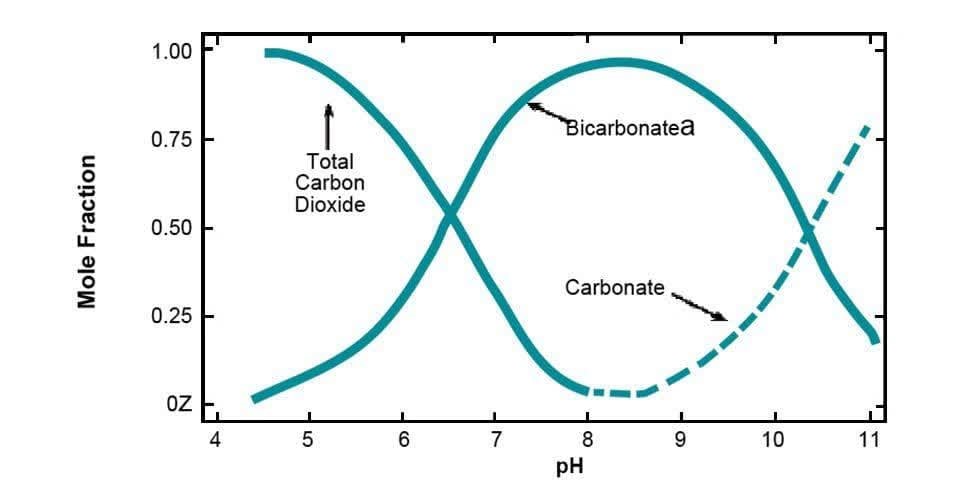
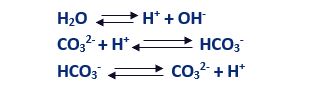
علاوه بر انحلال نمک های موجود در خاک، انحلال گاز دی اکسید کربن در آب نیز بر غلظت تعادلی یون ها تاثیر خواهد گذاشت. واکنش های مربوطه به شرح ذیل است:
با توجه به ماهیت تعادلی(برگشت پذیر) واکنش های فوق و حضور یون هیدروژن (H+) و یون هیدروکسید (OH–) در آنها، غلظت تعادلی هریک از یون های فوق وابسته به PH است.
به عنوان نمونه، غلظت های تعادلی هریک از یون های شرکت کننده در واکنش های فوق در دمای ۲۵ درجه سانتی گراد از نمودار ذیل قابل استخراج است.
در دمای دیگر نیز روابط ریاضی جهت محاسبه غلظت هریک از یون های فوق وجود دارد.
حضور غلظت های بالا از عوامل قلیائیت منجر به بروز طعم تلخ خواهد شد. از سوی دیگر، بررسی دقیق پارامتر قلیائیت به دلیل بروز رسوب گرفتگی در شرایطی است که این عوامل در کنار برخی یون های مثبت در آب (عوامل سختی) قرار گیرند.
اندازه گیری قلیائیت نمونه آب
اندازه گیری قلیائیت به روش تیتراسیون نمونه با یک اسید قوی و اندازه گیری متناوب تغییرات PH صورت می گیرد. قلیائیت به صورت میلی گرم بر لیتر (ppm) بر حسب کربنات کلسیم (CaCO3) بیان می شود. اگر از اسیدسولفوریک ۰٫۲ نرمال در تیتراسیون استفاده شود، هر میلی لیتر از اسید، خنثی کننده ۱ میلی گرم بر لیتر قلیائیت بر حسب کربنات کلسیم خواهد بود.
واکنش یون هیدروژن حاصل از این اسید با عوامل ایجاد قلیائیت، طبق معادلات ذیل خواهد بود:
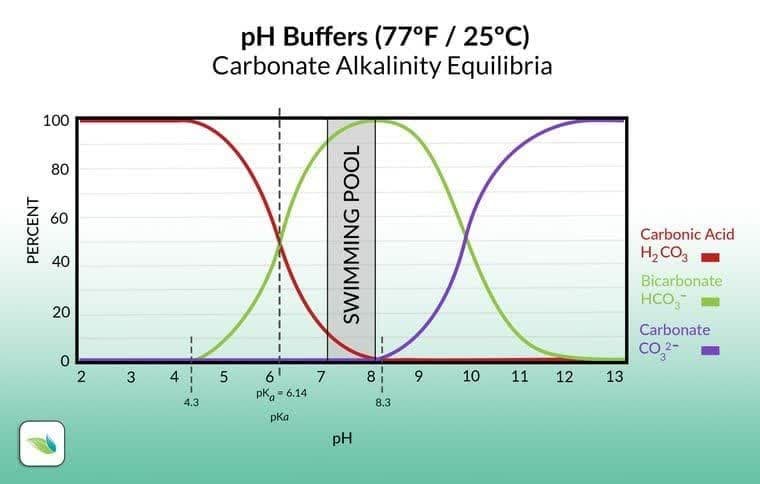
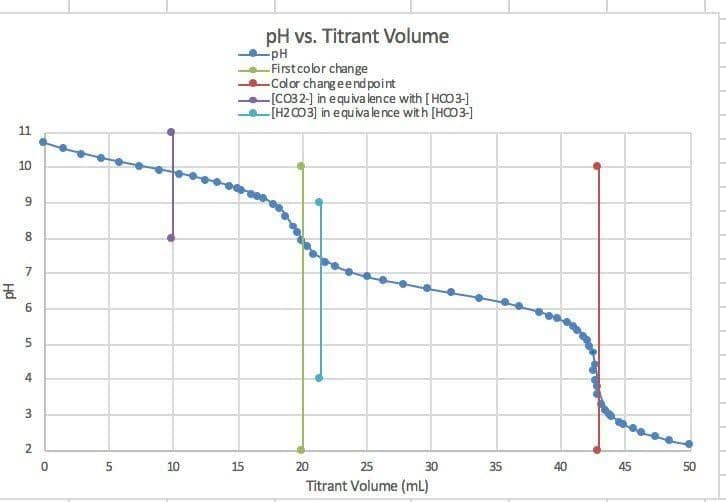
اگر اسید به آرامی به نمونه اضافه شده و PH به طور لحظه ای ثبت شود، منحنی مشابه نمودار ذیل به دست خواهد آمد:
مهم ترین جایگاه در منحنی فوق، نقاط عطف تغییر شیب نمودار در محدوده PHهای ۸٫۳ و ۴٫۵ است. تبدیل کربنات به بی کربنات مطابق با واکنش تعادلی فوق در PH حدود ۸٫۳ کامل می شود. از سوی دیگر، ممکن است آب به طور طبیعی خودش حاوی بی کربنات باشد که بخشی از اسید اضافه شده در آزمایش تیتراسیون را خنثی خواهد نمود. بنابراین خنثی سازی نیمی از کربنات موجود در آب در PH حدود ۸٫۳ انجام خواهد شد.
به دلیل اینکه تبدیل هیدروکسید به آب هم در PH حدود ۸٫۳ صورت خواهد گرفت، می توان چنین نتیجه گرفت که تمامی محتوای هیدروکسید و نیمی از محتوای کربنات در PH حدود ۸٫۳ خنثی خواهد شد. در PH حدود ۴٫۵ تمامی محتوای بی کربنات اعم از بی کربنات حاصل از کربنات و نیز بی کربنات طبیعی موجود در نمونه اولیه به اسیدکربنیک تبدیل خواهد شد.
کل اسید مصرفی تا رسیدن PH معادل ۴٫۵ بیانگر قلیائیت کل است. اگر حجم اسید مصرفی تا رسیدن به PH 8.3 مشخص شود، غلظت عوامل مختلف بروز قلیائیت مشخص خواهد شد. با توجه به اینکه تمامی محتوای هیدروکسید و نیمی از محتوای کربنات در PH 8.3 خنثی خواهند شد، میزان اسید لازم جهت خنثی سازی از PH 8.3 تا ۴٫۵ معادل غلظت نیمی دیگر از محتوای کربنات و نیز تمامی غلظت بی کربنات در نمونه اولیه است.
اگر P (قلیاییت فنل فتالئین) مقدار اسید لازم تا رسیدن به PH 8.3 و M (قلیاییت متیل اورانژ یا قلیاییت کل)، مقدار اسید لازم تا رسیدن به PH 4.5 باشد، چنین میتوان نتیجه گیری کرد:
اگر P=M باشد، تمامی قلیائیت ناشی از هیدروکسید (OH–) است.
اگر P=M/2 باشد، تمامی قلیائیت ناشی از کربنات (CO32-) است.
اگر P=0 باشد، PH اولیه آب کمتر از ۸٫۳ است و تمامی قلیائیت ناشی از بی کربنات (HCO3–) است.
اگر P<M/2 باشد، عمده عوامل قلیائیت، کربنات (CO32-) و بی کربنات (HCO3–) هستند.
اگر P>M/2 باشد، عمده عوامل قلیائیت، هیدروکسید (OH–) و کربنات (CO32-) هستند.




یک پاسخ
عالی بود