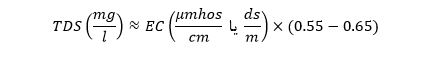هدایت الکتریکی(EC) آب آشامیدنی ناشی از یونهای محلول در آب می باشد. افزایش یونهای محلول منجر به افزایش هدایت الکتریکی آب و میزان شوری آب می شود. با افزایش شوری آب آشامیدنی و افزایش هدایت الکتریکی به بالاتر از ۱۰۰۰ میکروزیمنس بر سانتیمتر، آب آشامیدنی برای شرب گوارا نخواهد بود.
یون های محلول در آب آشامیدنی به عنوان انتقال دهنده الکترون ها عامل تعیین کننده هدایت الکتریکی آب هستند. با افزایش یون های محلول در آب، هدایت الکتریکی (Electrical Conductivity) آب نیز افزایش پیدا می کند. یون های محلول در آب با شاخص TDS(Total Dissolved Solid) بر حسب میلیگرم بر لیتر اندازه گیری می شوند. افزایش TDS و املاح محلول در آب به معنای افزایش EC و شوری آب می باشد.
هدایت الکتریکی(EC) آب آشامیدنی
هدایت الکتریکی (EC) آب به واسطه توانایی هدایت الکتریکی جریان در یک محلول اندازه گیری میشود. به دلیل اینکه جریان الکتریکی توسط یون ها در محلول انتقال می یابد، هدایت الکتریکی در اثر افزایش غلظت یونها افزایش مییابد، در نتیجه EC اندازه گیری شده تخمینی از غلظت کل جامدات محلول TDS در نظر گرفته میشود. امروزه EC آب از جمله پارامترهای مهم در تعیین مناسب بودن آب جهت آبیاری و مصارف کشاورزی است. شوری آب تصفیه شده که برای آبیاری استفاده خواهد شد با اندازه گیری هدایت الکتریکی تعیین میشود.
هدایت الکتریکی در سیستم آحاد U.S بر حسب میکروموس بر سانتی متر (µmhos/cm) و در سیستم آحاد SI بر حسب میلی زیمنس بر متر (ms/m) یا میکروزیمنس بر سانتیمتر بیان می شود. گفتنی است که µmhos/cm۱۰ برابر با ms/m 1 است. معادله ذیل برای تعیین TDS یک نمونه آب بر اساس مقدار EC اندازه گیری شده به دست می آید. (۱۹۹۵,Standard Methods)
وجود یون های محلول در آب آشامیدنی تا مقدار مشخص برای سلامتی انسان ها مطلوب و لازم است. بخشی از نیازهای بدن انسان به املاح معدنی نظیر کلسیم، منیزیم، بور و غیره از طریق آب آشامیدنی تأمین می شود. لیکن افزایش بیش از حد این املاح معدنی منجر به شوری و تلخی آب آشامیدنی شده و گوارایی آن را کاهش می دهد.
شاخص اصلی گوارا بودن آب آشامیدنی هدایت الکتریکی(EC) یا TDS آب می باشد. آب آشامیدنی با TDS کمتر از ۶۰۰ میلیگرم بر لیتر و هدایت الکتریکی(EC) کمتر از ۱۰۰۰ میکروزیمنس بر سانتیمتر برای شرب گوارا می باشد. با افزایش هدایت الکتریکی(EC) آب از ۱۰۰۰ تا ۱۶۰۰ طعم شوری آب افزایش پیدا می کند و به اصلاح آب مزه دار یا لب شور می شود. در صورت افزایش TDS آب از ۱۰۰۰ میلیگرم بر لیتر و هدایت الکتریکی آب به بالاتر از ۱۶۰۰ میکروزیمنس بر سانتیمتر، آب آشامیدنی برای نوشیدن گوارا نخواهد بود و طعم شوری قابل ملاحظه ای خواهد داشت.
اگرچه افزایش هدایت الکتریکی آب به بالاتر از ۱۰۰۰ میکروزیمنس بر سانتیمتر منجر به طعم دار شدن آب و کاهش گوارایی آن می شود. لیکن در استاندارد آب آشامیدنی در سازمان بهداشت جهانی حد مجازی برای هدایت الکتریکی(EC) آب آشامیدنی سالم مشخص نشده است.
کاتیون های مولد هدایت الکتریکی(EC) در آب آشامیدنی
یون های محلول در آب که ناشی از حل شدن ترکیبات نمکی می باشند به دو گروه کاتیون ها و آنیون ها تقسیم می شوند. یون های با بار الکتریکی مثبت نظیر کلسیم و منیزیم به عنوان کاتیون شناخته می شوند. هدایت الکتریکی (EC) آب آشامیدنی ناشی از وجود کاتیون ها و آنیون ها در آب می باشد. افزایش غلظت کاتیون ها و آنیون ها منجر به افزایش هدایت الکتریکی (EC) آب آشامیدنی می شود.
کلسیم در آب آشامیدنی
کلسیم در آب آشامیدنی بیشتر به صورت کربنات، بی کربنات و سولفات کلسیم ظاهر میشود. افزایش غلظت کلسیم منجر به افزایش سختی آب(Hardness) می شود. فرایندهای مختلف حذف سختی ار آب برای کاهش غلظت کلسیم مورد استفاده قرار میگیرد. سازمان بهداشت جهانی بیشینه غلظت کلسیم در آب آشامیدنی را ۲۰۰ میلی گرم در لیتر بر حسب کربنات کلسیم (میلی گرم در لیتر بر حسب کربنات کلسیم) پیشنهاد میکند. غلظت کلسیم در آب های طبیعی بین ۴۰ تا ۱۰۰ میلی گرم در لیتر گزارش شده است.
منیزیم در آب آشامیدنی

پتاسیم در آب آشامیدنی
غلظت پتاسیم در آب های طبیعی تا ۱۰ میلی گرم در لیتر گزارش شده است ولی در بیشتر آب های سطحی و زیرزمینی ایران غلظت پتاسیم کمتر از ۴ میلی گرم در لیتر اندازه گیری شده است. عنصر پتاسیم برای همه موجودات زنده به ویژه انسان بسیار مفید بوده و غلظت کمتر از ۴ میلی گرم در لیتر آن در خون انسان مشکل ساز خواهد بود به همین دلیل برای آب شرب که پتاسیم آن کمتر از ۴ میلی گرم در لیتر است اضافه کردن پتاسیم به صورت نمک پتاسیم توصیه میشود.
سدیم در آب آشامیدنی
مهم ترین نمک سدیم NaCl است که بسیار حلال است. غلظت سدیم در آبهای طبیعی از ۱۰ تا ۵۰ میلی گرم در لیتر به طور نرمال و بیش از ۶۰۰ میلی گرم در لیتر به صورت غیر نرمال گزارش شده است. خاک های ایران در اکثر نقاط کشور دربردارنده مقدار زیادی نمک NaCl بوده و در نتیجه غلظت بالای سدیم و کلر مشاهده شده است. استاندارد جهانی سازمان بهداشت جهانی میزان سدیم را معادل ۲۰ میلی گرم در لیتر در آب های آشامیدنی پیشنهاد کرده است.
آنیون های مولد هدایت الکتریکی(EC) در آب آشامیدنی
ذرات جامد یا یون های محلول در آب که ناشی از حل شدن ترکیبات نمکی می باشند به دو گروه کاتیون ها و آنیون ها تقسیم می شوند. یون های با بار الکتریکی منفی نظیر کربنات، سولفات، نیترات و غیره به عنوان آنیون شناخته می شوند. هدایت الکتریکی (EC) آب آشامیدنی با افزایش غلظت کاتیون ها و آنیون ها افزایش می یابد.
دی اکسید کربن، بی کربنات، کربنات در آب آشامیدنی
مقدار دی اکسید کربن آزاد در آب بستگی به PH و قلیائیت آب دارد و میتواند در مورد خاصیت خورندگی آب نقش مهمی ایفا کند. آبهای سطحی معمولاً کمتر از ۱۰ میلی گرم در لیتر CO2 آزاد دارند ولی برخی آب های زیرزمینی بیش از ۱۰۰ میلی گرم در لیتر CO2 دارند. روش ساده برای کاهش CO2 آب ها هوادهی پی در پی است. CO2 ضمن انحلال در آب با عوامل موجود در آن ترکیب میشود و یا در ترکیب با آب قسمتی از آن به صورت اسید کربنیک در آمده و قسمتی دیگر به یون های کربنات و بی کربنات تبدیل میشود. در آب های طبیعی که PH آن حدود ۸ است، بین کربنات و بی کربنات کلسیم موجود در آب تعادلی در اثر وجود CO2 ایجاد میشود که از ترسیب کربنات کلسیم جلوگیری میکند.
بی کربنات ها در آب آشامیدنی
بی کربنات ها از مهم ترین آنیون های موجود در آب های طبیعی میباشند که از حل شدن نمک های کربنات کلسیم و دولومیت و همچنین از ترکیبات CO2 با آب حاصل می شوند. بی کربنات ها در آب های طبیعی با PH بیش از ۹ از نمک های مختلف کربناته و CO2 تولید میشوند. غلظت بی کربناتها در آبهای طبیعی تا ۲۰۰ میلی گرم در لیتر گزارش شده است.
کلر آزاد در آب آشامیدنی
کلر ازاد مهمترین و مؤثرترین ماده گند زدای شیمیایی آب است. یکی از معایب کلرزنی آب ایجاد مزه کلری و کلروفنل است. چنانچه کلر به عنوان مادۀ پیش افزودنی قبل از تصفیه آب به آبهای رنگی یا آبهای حاوی مواد آلی (اسید هیومیک و اسید فولویک) اضافه گردد باعث تشکیل تری هالومتان ها می گردد. میزان کلر باقیمانده در آب آشامیدنی باید بین ۰٫۲ – ۰٫۵ میلی گرم در لیتر باشد.
کلرور در آب آشامیدنی
اغلب رودخانه ها و دریاچه ها دارای غلظت کلرور کمتر از ۵۰ میلی گرم در لیتر بر حسب – CL میباشند و هر گونه افزایش قابل توجه غلظت کلرور در آب، نشانه ای از آلودگی احتمالی به شمار می آید. کلرور سدیم غالب ترین ترکیب کلرور در آب است که باید برای بیماران قلبی و کلیوی مقدار آن محدود گردد. طبق استاندارد بیشینه غلظت مطلوب کلرور در آب آشامیدنی۲۰۰ و بیشینه غلظت مجاز آن ۶۰۰ میلی گرم در لیتر است. حس چشایی حساس میتواند مقدار کلرور معادل ۱۵۰ میلی گرم در لیتر را احساس نماید. غلظتهای بالای ۱۵۰ میلی گرم در لیتر کلرور سدیم باعث شور شدن مزه آب می گردد .
سولفات در آب آشامیدنی
سولفات ها ترکیبی از سولفور و اکسیژن بوده و به عنوان بخشی از مواد معدنی طبیعی در تشکیلات بعضی از خاکها و سنگها یافت میشوند. به مرور زمان این مواد معدنی حل شده و در آبهای زیرزمینی رها میشوند.
سولفات در آب آشامیدنی سهم عمده ای در سختی دائم یا غیر کربناتی دارد. غلظت بالای سولفات در تغییر طعم آب مؤثر بوده و اگر بیشتر از حد استاندارد باشد میتواند اثر مسهلی داشته باشد. مقدار مطلوب سولفات ۲۰۰ و بیشینه مجاز آن ۴۰۰ میلی گرم در لیتر است. بنا به گزارش EPA غلظت مجاز سولفات تا ۲۵۰ میلی گرم در لیتر میباشد. احیای سولفات توسط باکتریهای بی هوازی باعث تولید هیدروژن سولفوره (H2S) با بوی بد تخم مرغ گندیده می شود. غلظت مجاز سولفات در آبهای طبیعی تا ۵۰ میلی گرم در لیتر اندازه گیری شده است.
سولفیدهای هیدروژن در آب آشامیدنی دو شکل از سولفور، بیشتر در آب آشامیدنی یافت میشود. سولفات و سولفید هیدروژن که هر دو شکل نامطلوب بوده و معمولا به عنوان خطری برای سلامتی مطرح نمیشوند.
سولفید هیدروژن
باکتریهای احیاء کننده سولفور، که از سولفور به عنوان منبع انرژی استفاده میکنند، عمده ترین تولید کننده سولفید هیدروژن میباشند. این باکتریها از نظر شیمیایی در آب موجب تبدیل سولفات های طبیعی به سولفید هیدروژن میشوند. باکتریهای احیا کننده سولفور، در محیطهای فاقد اکسیژن از قبیل چاههای عمیق، سیستمهای لوله کشی منازل و دستگاه های گرم کننده آب یافت میشوند. همچنین گاز سولفید هیدروژن به طور طبیعی در برخی از آبهای زیرزمینی یافت میشود.
این ماده ممکن است از تجزیه مواد آلی همانند گیاهان پوسیده در زیر زمین حاصل شود. سولفید هیدروژن در چاه های عمیق یا سطحی نیز یافت میشود و میتواند از طریق چشمه ها وارد آب های

سطحی شده که البته در این حالت H2S به سرعت رها شده و وارد اتمسفر میشود. سولفید هیدروژن اغلب در چاه های حفر شده در مناطق سنگ رس یا ماسه سنگ، نزدیک معادن زغال سنگ یا رسوبات حاصل از کودهای گیاهی و یا میدانهای نفتی یافت میشود.
ترکیبات از ته آمونیاکی
آمونیاک یکی از اشکال ازت است و بیشتر بر حسب میلی گرم در لیتر ازت بیان میگردد. آب های چاه های عمیق با کیفیت آب خوب میتواند حاوی مقدار زیادی آمونیاک آزاد باشند که ممکن است در اثر احیای نیترات ها یا به وسیله باکتری ها و یا گذر آب از لایه های سنگی زمین به وجود آمده باشد. وجود آمونیاک در آب دلیلی بر آلودگی آن به فاضلاب خانگی یا صنعتی میباشد. میزان آمونیاک در آب تصفیه نشده ۳ میلی گرم در لیتر است و میزان آن در آب تصفیه شده تا ۰٫۴ میلی گرم در لیتر قابل قبول است.
نیترات و نیتریت
نیترات (NO3) و نیتریت (NO2) به طور معمول بر اساس میلی گرم در لیتر بر حسب ازت بیان میشوند. آب های سطحی به ندرت بیش از ۰٫۱ میلی گرم در لیتر بر حسب ازت نیتریت دارند مگر اینکه به شدت با فاضلاب آلوده شده باشند. بنابراین حضور نیتریت همراه با میزان بالایی آمونیاک در آبهای سطحی نشان دهنده آلودگی آب با فاضلاب است. نیترات آخرین مرحله اکسایش آمونیاک است که توسط باکتریهای نیتریفیکاسیون و در یک محیط با اکسیژن فراوان انجام می شود. آبی که دارای غلظت بالایی از نیترات باشد بالقوه برای شیر خواران و کودکان مضر میباشد، در معده کودکان نیترات به نیتریت تبدیل شده و جذب جریان خون می گردد و هموگلوبین را تبدیل به متهموگلوبین مینماید که باعث ایجاد پدیده کودکان آبی (blue baby) و متهموگلوبینمیا میگردد.
همچنین نیتریت باعث تشکیل نیتروزآمین ها میگردند که بالقوه سرطان زا می باشند. مقدار بیش از حد نیترات همراه با فسفات که با نام نوترینت شناخته میشوند می توانند در رودخانه ها باعث رشد بیش از حد جلبکها و پیری زودرس رودخانه گردند که به این پدیده «اوتریفیکاسیون» میگویند. بیشینه غلظت مجاز نیترات ۴۵ میلی گرم در لیتر NO3 و بیشینه غلظت مجاز نیتریت معادل ۰٫۱میلی گرم در لیتر بر حسب NO2 در آب تصفیه شده بیان شده است. غلظت مجاز نیترات بر اساس گزارش EPA آمریکا ۱۰ میلی گرم در لیتر بر حسب ازت است.
فسفات در آب آشامیدنی
فسفات از طریق فاضلابهای خانگی که حاوی دترجنت ها و پاک کننده های سنتتیک تهیه شده از فسفات میباشند یا از فسفات موجود در پسابهای کشاورزی و یا فاضلابهای صنعتی وارد آبهای سطحی می شود. فسفات نیز مانند نیترات از عناصر ضروری برای رشد جلبکها است و میتواند به مقدار قابل توجهی در اوتریفیکاسیون مخازن آب و دریاچه ها و رودخانه ها دخالت نماید . غلظت فسفات بیش از ۰٫۰۵ میلی گرم در لیتر در آبهای طبیعی باعث رشد و تکثیر بیش از حد جلبکها میشود.
مواد آلی
کل مواد آلی موجود در آب را میتوان از طریق اندازه گیری COD اکسیژن مورد نیاز شیمیایی BOD اکسیژن مورد نیاز بیوشیمیایی و کل کربن آلی (TOC) و مواد حاصل از استخراج کربن – کلروفروم تخمین زد.
سموم دفع آفات
سموم دفع آفات شامل ترکیب هایی مثل حشره کش ها، علف کش ها، مواد ضد قارچ و مواد ضد جلبک میباشند. روش بهتر جدا کردن این مواد از آب واکنش های اکسایش از طریق ازن، کلر، دی اکسید کلر و یا پرمنگنات پتاسیم است و در نهایت جذب توسط کربن فعال و صاف کردن در حذف آنها بسیار مؤثر است.
ترکیب های فنلی
ترکیب های فنلی که در آب های سطحی یافت میشوند بیشتر ناشی از فضولات صنایع مانند صنعت پتروشیمی و غیره است. این ترکیب ها با کلر حاصل از کلرینه کردن آب واکنش داده و کلروفنل ها را به وجود میاورند که مولد بو و طعم در آب هستند. اکسایش با ازن و جذب سطحی توسط کربن فعال و سوپرکلریناسیون در حذف فنلها در آب بسیار مؤثرند. البته مقادیر پایین این آلاینده ها تأثیر زیادی در هدایت الکتریکی(EC) آب آشامیدنی ندارد و تنها از منظر سلامت انشانها اهمیت دارد.
تری هالومتان ها (THMS)
زمانی که کلر به عنوان گندزدا جهت تصفیه آب به کار میرود، کلر با مواد آلی مانند اسید هومیک و اسیدفولویک ترکیب شده و تری هالومتان ها یا هالوفرم ها را ایجاد میکنند که خاصیت سرطان زایی دارند. مؤثرترین روش کاهش تری هالومتان ها در آب های آشامیدنی کاستن غلظت مواد آلی موجود در آب قبل از گندزدایی آن با کلر است. همچنین باید کاربرد کلر را در مرحله قبل از کلرزنی محدود ساخت. البته مقادیر پایین این آلاینده ها تأثیر زیادی در هدایت الکتریکی(EC) آب آشامیدنی ندارد و تنها از منظر سلامت انشانها اهمیت دارد.
پاک کننده ها
پاک کننده ها یا مواد فعال کننده سطحی از جمله موادی هستند که در آب تولید کف می نمایند، این مواد باعث ایجاد کف، اثر روی مزه و بوی آب، اشکال در امر انعقاد و ته نشینی و صاف کردن، ایجاد واکنش های فیزیولوژیکی در انسان و اثر سوء روی موجودات زنده و کاهش نفوذ نور خورشید به درون آب رودخانه ها میگردند. بیشینه غلظت این مواد در آبهای تصفیه شده ۰٫۲ میلی گرم در لیتر پیشنهاد میگردد.
هدایت الکتریکی(EC) آب صنعتی
هدایت الکتریکی(EC) یکی از شاخصهای اصلی کیفی آب صنعتی نیز محسوب می شود. خالص سازی آب برای کاربردهای صنعتی برای مصارف مختلف نظیر بویلرهای صنعتی، سیستمهای خنک کننده، آب مورد نیاز فرایندی و غیره با شاخص کیفی هدایت الکتریکی(EC) سنجیده می شود.
آب مورد نیاز در مصارف صنعتی برای حصول آب دمین یا آب فوق خالص(Ultra Pure Water) خالص سازی می شود. در فرایندهای مختلف تصفیه و خالص سازی، هدایت الکتریکی(EC) آب کاهش پیدا می کند. به طوریکه هدایت الکتریکی(EC) آب دمین معمولاً به کمتر از ۵ میلیگرم بر لیتر و آب فوق خالص به کمتر از ۱ یا ۰٫۱ میکروزیمنس بر سانتیمتر کاهش پیدا می کند. کاهش هدایت الکتریکی(EC) آب در دستگاه دیونایز انجام می شود.