حذف آهن و منگنز محلول در آب از منظر سلامت آب آشامیدنی، جلوگیری از رسوب گرفتگی خطوط انتقال، جلوگیری از خوردگی و گرفتگی غشاهای اسمز معکوس حایز اهمیت است. شرکت مهندسی فران راه حل های صنعتی حذف آهن و منگنز از آب را برای کاربریهای مختلف صنعتی و شرب ارائه می کند.
منابع زیرزمینی آب خام بعضاً حاوی مقادیر قابل توجهی از آهن و منگنز هستند. وجود مقادیر استاندارد از این عناصر در آب شرب برای سلامتی سودمند است. لیکن وجود غلظت های بالا از این عناصر در آب، ضمن تغییر نامطلوب در رنگ و طعم آب شرب تأثیر نامطلوبی بر سلامتی خواهد گذاشت.
وجود غلظتهای بالای آهن و منگنز در آب، چالشهای مختلفی در بهره برداری خطوط انتقال آب و فرایندهای تصفیه غشایی به دنبال دارد. از اینرو حذف آهن و منگنز مازاد در آب به جهت کاهش هزینه های نگهداری و تعمیرات خطوط لوله و آب شیرین کن های صنعتی ضروری است.
آهن در آب آشامیدنی و تأثیر آن بر سلامت
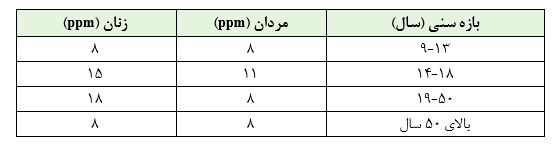
مقادیر توصیه شده مصرف روزانه آهن به تفکیک جنسیت و گروه سنی افراد براساس بنیاد ملی سلامت آمریکا(NIH) به شرح جدول ذیل است:
مصرف مقادیر بالاتر از ارقام فوق برای سلامتی انسان خطر چندانی ندارد و ممکن است باعث افزایش غلظت خون گردد. مشکل عمده در بالابودن غلظت آهن در آب آشامیدنی، ایجاد مزه نامطبوع متالیک (فلزی) در آب و نیز ایجاد لکه های زرد و یا قهوه ای رنگ بر روی البسه با رنگ های روشن است. وجود آهن در آب منجر به تشدید رشد بیولوژیکی و تشکیل لجن در جداره لوله انتقال آب می گردد.
منگنز در آب آشامیدنی سالم و تأثیر آن بر سلامت
منگنز یکی از عناصر مهم در رژیم غذایی انسان است که غلات و دانه های روغنی منابع مهم تأمین آن هستند. مقدار مصرف روزانه توصیه شده منگنز توسط FDA برای کودکان بزرگتر از ۴ سال و بزرگسالان ۳/۲ میلی گرم است. مصرف بی رویه عنصر منجر به اختلالات در رشد جنین در دوران بارداری و نیز نوزادان می باشد. از سوی دیگر کمبود این عنصر در رژیم غذایی باعث بروز اختلال در متابولیسم کربوهیدرات خواهد شد.
مشکلات ناشی از آهن و منگنز در آب صنعتی
وجود بیش از اندازه این عناصر باعث بروز مشکلات متعددی می شود که برخی از آنها عبارت اند از:
- رسوب گرفتگی ناشی از آهن در خطوط لوله
- ایجاد ظاهری بسیار ناخوشایند بر روی سطوح مانند سنگ و سرامیک
- تشدید رشد بیولوژیکی و تولید لجن بیولوژیک و ایجاد مشکل انسداد در تأسیسات
- ایجاد رسوب گرفتگی در فرایندهای فیلتراسیون غشایی و اسمز معکوس
- ایجاد آلودگی رزینی و اختلال در عملکرد فرایند تبادل یون
فرایندهای حذف آهن و منگنز از آب
حذف آهن و منگنز از آب با فرایندهای ترسیب، تبادل یون، اکسیداسیون و جذب سطحی از آب در مقیاس صنعتی انجام می شود. انتخاب فرایند بهینه وابسته به غلظت آن و منگنز، کاربری مورد نظر و هزینه های بهره برداری است.
به طور خلاصه مهم ترین فرایند های حذف آهن و منگنز در تصفیه آب شرب و صنعتی را می توان در سه گروه ذیل خلاصه کرد:
-اکسیداسیون توسط اکسیژن و یا مواد اکسیدکننده از قبیل کلر، دی اکسید کلر، پرمنگنات پتاسیم و ازن و متعاقب آن انجام فرایند ته نشینی و فیلتراسیون تکمیلی
-اکسیداسیون و فیلتراسیون همزمان با ماسه سبز (Green sand) یا زئولیت منگنز
-فرایند تبادل یون (Ion Exchange) و استفاده از رزین های خاص
اکسیداسیون
آهن و منگنز در حالت یون دو ظرفیتی در آب محلول هستند. یکی از روش های حذف این دو عنصر، تبدیل آنها به فرم نامحلول است. آهن سه ظرفیتی و منگنز چهار ظرفیتی فرم های بسیار نامحلول این عناصر هستند.
با تأمین اکسیژن محلول در آب از طریق هوادهی و یا استفاده از مواد اکسیدکننده مانند کلر، دی اکسید کلر، پرمنگنات پتاسیم و ازن و تبدیل این عناصر به فرم نامحلول می توان آن ها را تا حد مطلوب حذف نمود.
واکنش های اکسیداسیون توسط اکسیژن محلول (هوادهی) به شرح ذیل است:
همانطور که از واکنش های فوق قابل مشاهده است، اگر H+ تولیدی در این واکنش ها توسط عاملی داخلی مانند قلیائیت در آب خام و یا تزریق ماده قلیایی مانند آهک، به مصرف برسد، تعادل به سمت راست متمایل شده و منجر به حذف بهتر آهن و منگنز خواهد شد.
همچنین استوکیومتری واکنش های فوق نشان می دهد، مقدار بسیار کمی از اکسیژن محلول می تواند باعث حذف مقادیر قایل توجهی از آهن و منگنز محلول در آب شود.
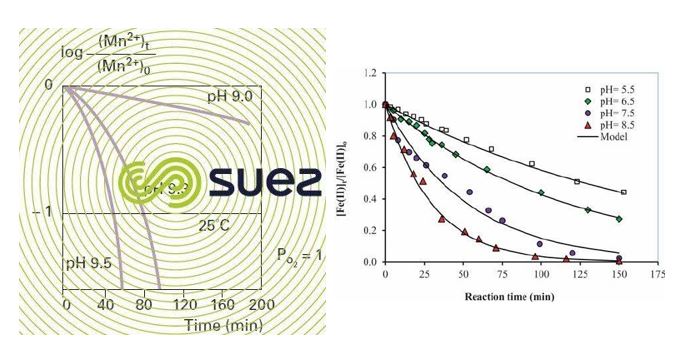
محدوده بهینه PH برای اکسیداسیون سریع آهن در بازه ۹-۷ و برای اکسیداسیون منگنز در بازه ۵/۱۰-۹ است. اگر آب حاوی CO2 محلول باشد، جهت تنظیم PH به محدوده بهینه برای حذف آهن و منگنز می توان از هوادهی و دفع این گاز استفاده کرد.
اگر آب خام حاوی آلودگی هایی با ماهیت آلی مانند هیومیک اسید و فالویک اسید (ناشی از تجزیه گیاهان و جلبک) باشد، آهن تمایل زیادی به تشکیل کمپلکس های آبدار داشته که امکان اکسیداسیون آن با اکسیژن محلول در زمان معقول وجود ندارد؛ لذا در این شرایط از اکسیدکننده های قوی تر مانند موادی که در بالا به آن اشاره شد استفاده میکنند و معمولاً در غلظت های بالاتر از ۱۰ میلی گرم بر لیتر آهن و منگنز از فرایند اکسیداسیون شیمیایی استفاده می شود.
نمودار های ذیل گویای سرعت واکنش اکسیداسیون به PH است:
در شرایطی که آب حاوی مواد آلی باشد و یا لازم باشد که سرعت واکنش اکسیداسیون افزایش یابد، به جای استفاده از اکسیژن محلول از اکسیدکننده های قوی تر استفاده می شود.
با به کارگیری این اکسیدکننده ها علاوه بر اکسیداسیون آهن و منگنز، محتوای COD آب نیز کاهش یافته و این موضوع خود باعث بهبود کیفیت فرایند انعقاد و لخته سازی خواهد شد.
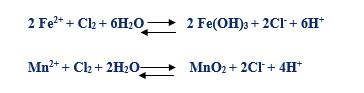
فرایند اکسیداسیون آهن و منگنز با کلر به شرح ذیل است:
در واکنش های فوق نیز می توان چنین نتیجه گیری کرد که حذف H+ تولیدی با افزایش ماده قلیایی باعث متمایل شدن فرایند به سمت راست و در نتیجه حذف بهتر آهن و منگنز خواهد شد.
یکی از آلودگی های شایع در آب های زیر زمینی وجود ترکیبات گوگردی نظیر گاز H2S محلول است. این موضوع خصوصاً در آب های زیرزمینی نزدیک مناطق آتشفشانی و چشمه های آب گرم بسیار متداول است.
در چنین حالتی بخشی از ماده اکسیدکننده مصرفی، صرف اکسیداسیون H2S می شود:
در صورتی که غلظت H2S محلول در آب قابل توجه باشد، منطقی است که جهت کاهش مصرف مواد شیمیایی، ابتدا گاز محلول از آب دفع گردد.
حذف آهن و منگنز با استفاده از ماسه سبز (Green sand) یا زئولیت منگنز
در این بسترها فیلمی از یون پرمنگنات بر روی دانه های زئولیت وجود دارد.
با عبور آب از بستر، یون پرمنگنات، محتوای آهن و منگنز را به فرم نامحلول آن اکسید کرده و هم زمان فیلتراسیون درون بستر انجام می شود. بدیهی است با گذشت زمان لازم است این بسترها با محلول پرمنگنات پتاسیم احیا شده و همچنین فرایند شستشوی معکوس جهت حذف رسوبات انباشته شده در بستر صورت پذیرد.
با توجه به گران قیمت بودن پرمنگنات پتاسیم در مقایسه با اکسیدکننده های دیگر، استفاده از این فرایند تنها در حالتی که مقدار آهن و منگنز در آب کم باشد، مقرون به صرفه است.
حذف آهن و منگنز با استفاده از فرایند تبادل یون (Ion Exchange)
آهن و منگنز همچون سایر کاتیون های موجود در آب طی فرایند تبادل یون توسط رزین مدار سدیمی و یا رزین مدار هیدروژنی قابل جذب و حذف هستند.
نکته مهم در به کارگیری این فرایند در حذف این عناصر، جلوگیری از تبدیل این عناصر به فرم نامحلول، قبل از ورود به بسترهای رزینی منجر به آسیب جدی به کیفیت رزین و کاهش کارایی فرایند تبادل یون خواهد شد. این موضوع تا آنجا اهمیت دارد که لازم است محلول های احیاکننده بستر رزین نیز عاری از اکسیژن محلول گردند. همچنین می بایست از تماس هوا با آب قبل از ورود به بستر رزینی اطمینان حاصل نمود.
گاهی به دلیل کم بودن غلظت آهن و منگنز در آب و یا کم بودن حجم آب مورد استفاده در صنعت، طراحی و اجرای فرایند های حذف آهن و منگنز مقرون به صرفه نیست. از سوی دیگر ممکن است در یک واحد صنعتی به دلیل کمبود فضای جانمایی و یا عدم وجود بهره بردار متخصص در راهبری فرایند های تصفیه آب، امکان انجام فرایندهای حذف آهن و منگنز فراهم نباشد.
در این حالت می توان با تزریق مواد شیمیایی مناسب از قبیل ترکیبات پلی سولفات از تشکیل رسوب آهن و منگنز در تأسیسات جلوگیری نمود.
اساس عملکرد این مواد، تشکیل کمپلکس های پایدار و در نتیجه جلوگیری از تشکیل رسوب است.
به عنوان یک قاعده سرانگشتی به ازای هر میلی گرم آهن یا منگنز در آب می توان ۴ تا ۶ میلی گرم هگزامتافسفات سدیم استفاده نمود تا از عدم تشکیل رسوب در سیستم اطمینان حاصل گردد.
مقرون به صرفه بودن استفاده از مواد شیمیایی پلی فسفات، منوط به غلظت کم آهن و منگنز در آب تا حداکثر ۲ میلی گرم بر لیتر است.
باید توجه نمود که تزریق بی رویه این مواد منجر به افزایش ویسکوزیته آب و تبعات نامطلوب آن بر سایر فرایندها و نیز بروز مشکلات گوارشی در صورت نوشیدن آب حاوی این مواد خواهد شد.
همچنین تأثیر تزریق این مواد جهت جلوگیری از رسوب آهن به مراتب بیشتر از منگنز است.
شرکت مهندسی فران با بیش از ۱۷ سال تجربه در صنعت تصفیه آب و پساب صنعتی، مجری پروژه های طرح و ساخت در زمینه تصفیه آب و پساب می باشد.